Neurobiología del TOC
A nivel cerebral, la neurobiología y causas del trastorno obsesivo-compulsivo (TOC) son la suma de diferentes mecanismos complejos, que implican la anatomía cerebral, las hormonas, los sistemas de transmisores etc. Aún así, existen estudios muy interesantes y teorías consolidadas que nos ayudan a esclarecer el porqué de este trastorno.
A nivel general, está comprobado que tanto factores genéticos como ambientales interaccionan en el riesgo de aparición del TOC (Mataix-Cols et al., 2013).
Neurotransmisores
Actualmente, la hipótesis más consolidada sobre la aparición y mantenimiento de la sintomatología obsesivo-compulsiva implica la serotonina. Este es un neurotransmisor implicado en diversos procesos cognitivos: modulación del estado del ánimo, aprendizaje, memoria, respuestas fisiológicas etc.
Todo parece indicar que bajos niveles de serotonina producen respuestas inusuales, sobreexcitando la activación en el córtex orbitofrontal (Mavrogiorgou, Enzi, Steinmann, Mulert, & Juckel, 2018). El córtex orbitofrontal trabaja, conjuntamente con otros circuitos cerebrales, para inhibir las respuestas desadaptativas en el comportamiento, seleccionando y regulando aquellas otras secuencias conductuales útiles para el organismo (Evans, Lewis, & Iobst, 2004). Por tanto, esta desregulación serotoninérgica parece que puede hacer aparecer y afianzar obsesiones recurrentes de cualquier tipo (limpieza, orden, control).
Por ello, los medicamentos que inhiben la recaptación de serotonina (ISRS) son la primera opción para el tratamiento del TOC (Murphy et al., 2013). Aún así, estudios exhaustivos a doble ciego de diversos fármacos, hechos ya hace décadas, revelan que no podemos hacer reduccionismo con la hipótesis de la serotonina. Estos estudios demuestran que el bloqueo farmacológico por sí mismo de la recaptación de serotonina no es suficiente para generar una respuesta antiobsesiva (Insel, Mueller, Alterman, Linnoila & Murphy, 1985).
Otro neurotransmisor importante, la dopamina, se encarga entre otras funciones de la motivación y la recompensa. Aunque su rol en la génesis y mantenimiento del TOC fue menos estudiado, pero no por ello es un factor estructural en el mantenimiento del TOC. En estudios de neuroimagen de pacientes con TOC se observaron disfunciones en las zonas prefrontales y en el ganglio basal (estriado, tálamo y amígdala), normalmente el TOC está asociada a una hiperfuncionalidad dopaminérgica en las zonas prefrontales, aunque la serotonina predomina en el ganglio basal en estos casos. Por lo tanto, estas estructuras cerebrales implicadas en el TOC se denominan en su conjunto el circuito cortico-estriado-talámico. El circuito cortico-estriado-talámico es disfuncional y está bien establecida su relación con el TOC. En este circuito, la dopamina es el neurotransmisor más importante, de ahí la importancia en ampliar las líneas de investigación en su influencia en el TOC (Koo, Kim, Roh, & Kim, 2010).
En cuanto al GABA, es el responsable del control motor, la visión y funciones corticales de inhibición. El GABA ha demostrado su relevancia en los trastornos de ansiedad (y el TOC tiene un componente ansiógeno muy importante). Receptores GABAA regulan la inhibición de los circuitos neuronales conectados con la amígdala (encargada del funcionamiento del «miedo»). Por ello, desregulaciones en este neurotransmisor pueden hacer que el cerebro identifique estímulos anteriormente neutros como peligrosos, aumentando el nivel de alerta y ansiedad; agravando el ciclo de rumiación y compulsión (Nuss, 2015).
Hormonas
Se ha demostrado que existe una relación entre el aumento del estrés percibido y niveles basales de cortisol en pacientes diagnosticados de TOC comparados con un grupo control (Morgado, Freitas, Bessa, Sousa, & Cerqueira, 2013). La conclusión de este estudio fue que los pacientes con TOC presentan niveles basales más altos de cortisol. Esta hormona es clave en el eje hipotálamo-hipofisario-adrenal, que regula los niveles de estrés y alerta en el organismo.
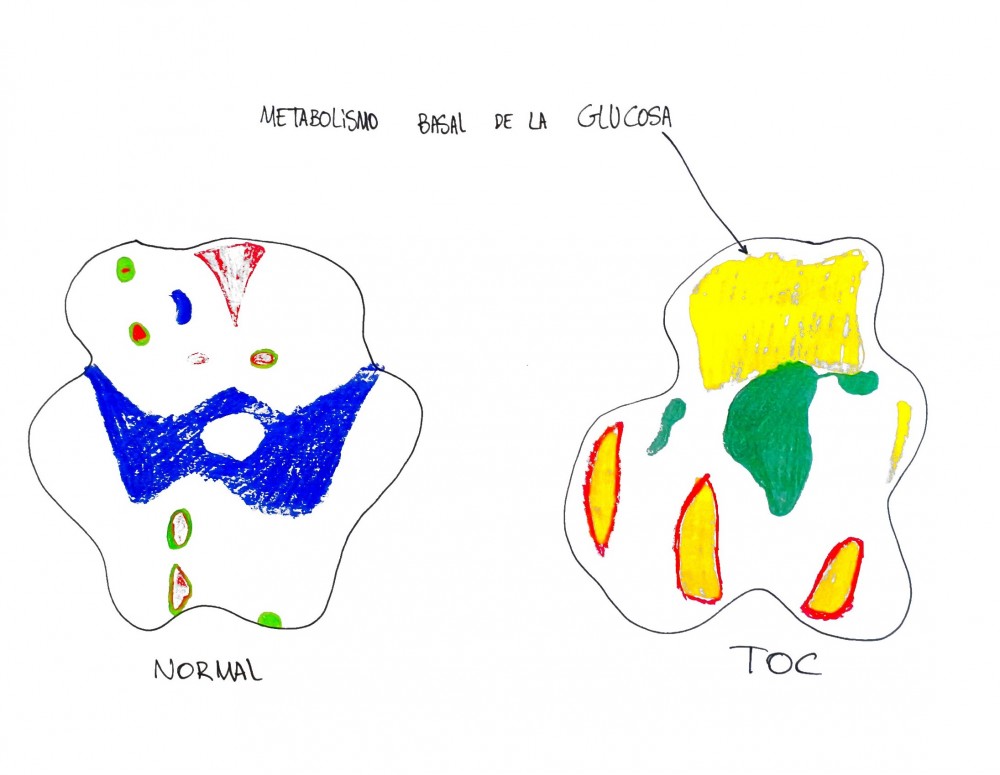
Metabolismo basal de la glucosa
En los estudios de neuroimagen (PET, resonancia magnética funcional o RMNf), se asocian un aumento de los niveles de glucosa en el cerebro a una activación mayoritaria de aquellas zonas que se activan en los resultados de las pruebas durante la RMNf.
En los estudios con RMNf se observa que los pacientes con TOC muestran niveles superiores de glucosa al grupo control en el circuito lateral del córtex orbitofrontal, el núcleo caudado, y el córtex cingulado anterior. Al estar este circuito hiperexcitado, los pacientes no pueden inhibir de manera exitosa respuestas disfuncionales (Baxter, 1990).
Neuropsicología
Evans, Lewis e Iobst (2004) resaltan la importancia de dos estructuras en la génesis del TOC: el córtex orbitofrontal (mencionado anteriormente) y el córtex dorsolateral prefrontal. El córtex dorsolateral prefrontal se asocia con el cambio entre tareas, planificación y memoria de trabajo. El déficit en el funcionamiento de ambos sistemas provoca problemas en las siguientes áreas:
- Memoria de trabajo: sobre todo con la memoria visoespacial.
- Alternancia y cambio entre tareas: los pacientes con TOC se caracterizan por presentar rigidez cognitiva. La rigidez cognitiva les impide adaptarse a situaciones nuevas o cambiantes.
- Inhibición de respuesta: los sujetos con TOC puntuaron peor en tareas de supresión de respuestas automáticas, sobre todo en tareas oculomotoras.
Genética
En los estudios de prevalencia del trastorno en familias, está demostrado que la probabilidad de sufrirlo aumenta proporcionalmente a la consanguineidad. Es decir, el riesgo de tener el trastorno es mayor si existe en familiares de primer grado, y va disminuyendo de manera progresiva en familiares de segundo y tercer grado. En estudios con gemelos, se ha comprobado que el riesgo familiar del TOC era principalmente atribuible a factores genéticos innatos y no tanto por factores ambientales (Mataix-Cols et al., 2013).
Por último, en cuanto a los genes específicos para el TOC, el transportador de serotonina SLC6A4 ha sido uno de los más investigados en relación con el trastorno, ya que los fármacos que producen la inhibición de la recaptación de serotonina son el tratamiento médico más común. También, la existencia de un polimorfismo en un gen asociado al envío de serotonina en regiones polimórficas (5-HTTLPR) provoca una mayor expresión génica en el alelo L y baja expresión en el alelo S. Esta circunstancia ha sido relacionada con el trastorno obsesivo-compulsivo, siendo el alelo L el considerado de riesgo.
Autores: David Cueto, Jaume Guilera.
Como citar el post en estilo APA:
Cueto,D.,Guilera,J. (2020, February 10).Neurobiología del TOC. blog.mentelex.com. https://blog.mentelex.com/neurobiologia-del-toc/
También te puede interesar:
Bibliografía
– Baxter, L. R. (1990). Brain imaging as a tool in establishing a theory of brain pathology in obsessive compulsive disorder. The Journal of Clinical Psychiatry, 51(2, Suppl), 22–25.
– Evans, D. W., Lewis, M. D., & Iobst, E. (2004). The role of the orbitofrontal cortex in normally developing compulsive-like behaviors and obsessive–compulsive disorder. Brain and cognition, 55(1), 220-234.
– Insel, T. R., Mueller, E. A., Alterman, I., Linnoila, M., & Murphy, D. L. (1985). Obsessive-compulsive disorder and serotonin: is there a connection?. Biological Psychiatry, 20(11), 1174-1188.
– Koo, M. S., Kim, E. J., Roh, D., & Kim, C. H. (2010). Role of dopamine in the pathophysiology and treatment of obsessive–compulsive disorder. Expert review of neurotherapeutics, 10(2), 275-290.
– Mataix-Cols, D., Boman, M., Monzani, B., Rück, C., Serlachius, E., Långström, N., & Lichtenstein, P. (2013). Population-based, multigenerational family clustering study of obsessive-compulsive disorder. JAMA psychiatry, 70(7), 709-717.
– Mavrogiorgou, P., Enzi, B., Steinmann, S., Mulert, C., & Juckel, G. (2018). Relationship Between Neuroanatomical and Serotonergic Hypotheses of Obsessive-Compulsive Disorder: A Combined Functional Magnetic Resonance Imaging-Evoked Potential Study. The Journal of clinical psychiatry, 79(6).
– Morgado, P., Freitas, D., Bessa, J. M., Sousa, N., & Cerqueira, J. J. (2013). Perceived stress in obsessive–compulsive disorder is related with obsessive but not compulsive symptoms. Frontiers in psychiatry, 4(21).
– Murphy, D. L., Moya, P. R., Fox, M. A., Rubenstein, L. M., Wendland, J. R., & Timpano, K. R. (2013). Anxiety and affective disorder comorbidity related to serotonin and other neurotransmitter systems: obsessive–compulsive disorder as an example of overlapping clinical and genetic heterogeneity. Philosophical Transactions of the Royal Society B: Biological Sciences, 368(1615)
– Nuss, P. (2015). Anxiety disorders and GABA neurotransmission: a disturbance of modulation. Neuropsychiatric disease and treatment, 11. 165-175



